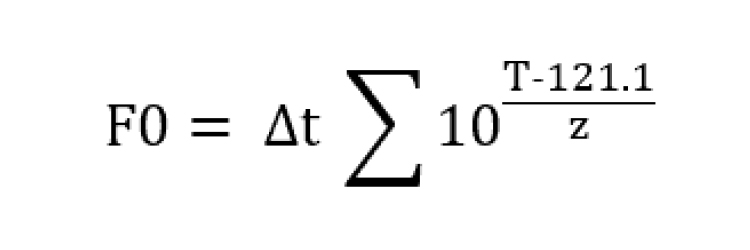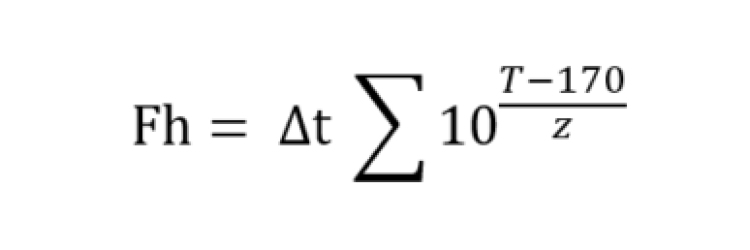GxP Wörterbuch
A
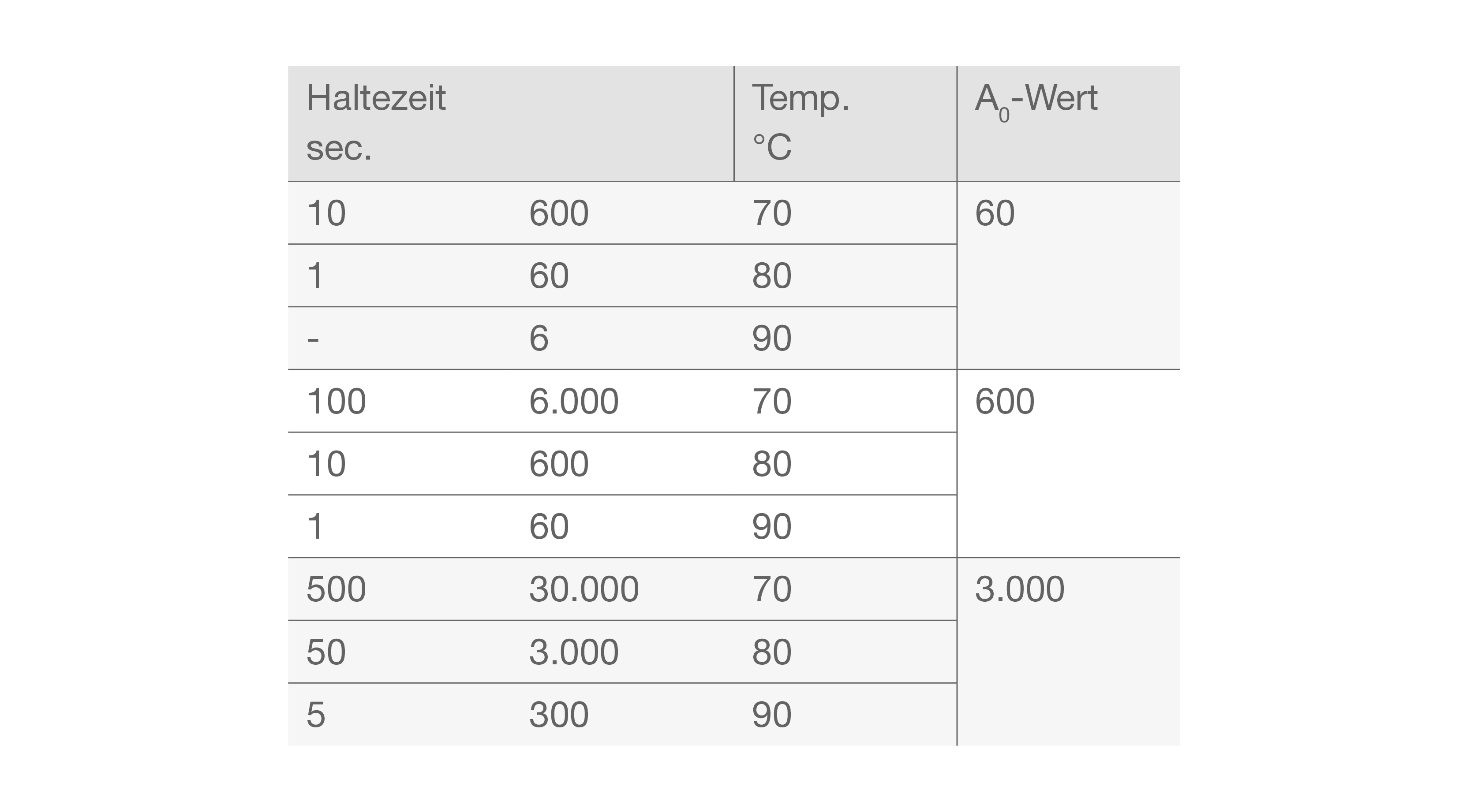
A0-Value (A0 -Wert, Letalitätswert)
A
ALCOA (++) Prinzip
A
Annex 1
A
API – Active Pharmaceutical Ingredient (Wirkstoff)
A
APR – Annual Product Review (Jährliche Produktüberprüfung)
A
Audit
A
Audit Trail
B
Bioburden (Keimbelastung)
B
BP – British Pharmacopoeia (Arzneibuch UK)
C
21 CFR – Code of Federal Regulations
C
21 CFR part11
C
Calibration (Kalibrierung)
C
Calibration Protocol (Kalibrierungsprotokoll)
C
CAPA – Corrective and Preventive Action (Korrektur- und Vorbeugungsmaßnahmen)
C
CC – Change Control (Änderungskontrolle)
C
CFR – Code Federal Regulations (Bundesrichtlinien der USA)
C
CFU – Colony Forming Unit (Koloniebildende Einheit KBE)
C
ChP – Chinese Pharmacopoeia (Arzneibuch China)
C
CIP – Clean in Place (Ortsgebundene Reinigung)
C
Cold Chain (Kühlkette)
C
Cold Chain Management (Kühlketten-Management)
C
Compliance (Einhaltung von Vorschriften)
C
Concurrent Validation (Begleitende Validierung)
C
CPV – Continued Process Validation (Fortlaufende Validierung)
C
CQA – Critical Quality Attributes (Kritische Qualitätsmerkmale)
C
CSV – Computer-System/ -Software-Validation
D
D-Value (D-Wert)
D
Data Integrity (Datenintegrität)
D
Design Specifications
D
Deviation (Abweichung)
D
Deviation Management (Abweichungsmanagement)
D
DMS – Document Management System (Dokumentenmanagementsystem)
D
DQ – Design Qualification (Design Qualifizierung)
E
EMA – European Medicines Agency (Europäische Arzneimittel-Agentur)
E
EP – oder Ph.Eur European Pharmacopeia (Europäisches Arzneibuch)
E
EU-GMP – Annex (Anhang)
E
EU-GMP Annex 11 – Computergestützte Systeme
E
EU-GMP Annex 15 – Qualifizierung und Validierung
E
EU-GMP Annex 20 – Qualitäts-Risikomanagement
E
EU-GMP Leitfaden
F
F0-Value (F0-Wert, Letalitätswert)
F
FAT – Factory-Acceptance-Test (Werksabnahme)
F
FDA – 482 (FDA-Inspektionsformular)
F
FDA – 483 (FDA-Mängelbericht)
F
FDA – Food and Drug Administration
F
FDA – Warning Letter (FDA-Abmahnung)
F
FDA Guidance for Industry – Process Validation
F
Fh-Value (FH -Wert, Wärmepenetrationsfaktor)
F
FMEA – Failure Mode and Effects Analysis (Fehlermöglichkeits- und Einflussanalyse)
F
FMECA – Failure Mode, Effects, and Criticality Analysis
F
FTA – Fault Tree Analysis (Fehlerbaum-Analyse)
G
GAMP® – Good Automated Manufacturing Practice (Gute Automatisierte Herstellungspraxis)
G
GAMP® 5V-Modell (V-Modell)
G
GCP – Good Clinical Practice
G
GDP – Good Distribution Practice
G
GEP – Good Engineering Practice
G
GLP – Good Laboratory Practice
G
GMP – Good Manufacturing Practice (Gute Herstellungspraxis) / cGMP – current Good Manufacturing Practice (Aktuelle Gute Herstellungspraxis)
G
GSP – Good Storage Practices
G
GxP/ cGxP
H
HACCP – Hazard Analysis and Critical Control Points (Gefahrenanalyse und kritische Kontrollpunkte)
H
HAZOP – Hazard and Operability Study (Gefahren- und Funktionsfähigkeitsstudie)
I
ICH – International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use
I
ICH Q9 – Quality Risk Management – Scientific Guideline
I
IQ – Installation Qualification (Installationsqualifizierung)
I
ISPE® – International Society for Pharmaceutical Engineering
I
ISPE® GAMP® 5 – Risikobasierter Ansatz für konforme computergestützte Systeme
J
JP – Japanese Pharmacopeia (Arzneibuch Japan)
L
LVP – Large Volume Parenteral
O
OOE – Out-of-Expectation (Außerhalb der Erwartungen)
O
OOS – Out-of-Specification (Außerhalb spezifizierter Akzeptanzkriterien)
O
OOT – Out-of-Trend
O
OQ – Operational Qualification (Funktionsqualifizierung)
P
PAT – Process Analytical Technology (Prozessanalysentechnologie)
P
PCS – Process Control System (Prozesssteuerungssystem)
P
PDA® Parenteral Drug Association
P
PHA – Preliminary Hazard Analysis (Vorgezogene Gefahrenanalyse)
P
PIC/S® – Pharmaceutical Inspection Cooperation Scheme
P
PPQ – Process Performance Qualification (Prozessleistungsqualifizierung)
P
PQ – Performance Qualification (Leistungsqualifizierung)
P
PQR – Product Quality Review (Produktqualitätsüberprüfung)
P
Predictive Maintenance (Prädiktive Wartung)
P
Preventive Maintenance (Präventive Wartung)
P
Prospective Validation or Premarket Validation (Prospektive Validierung)
P
PS – Purified Steam (Reindampf)
P
PV – Process Validation (Prozessvalidierung)
P
PW – Purified Water (Gereinigtes Wasser)
Q
QA – Quality Assurance (Qualitätssicherung QS)
Q
QbD – Quality-by- Design (Qualität durch Design)
Q
QC – Quality Control (Qualitätskontrolle)
Q
QMS – Quality Management System (Qualitätsmanagementsystem)
Q
QP – Qualification Protocol (Qualifizierungsprotokoll)
Q
QP – Qualified Person (Sachkundige Person)
Q
QSM – Quality System Manual (Qualitätssicherungshandbuch QSH)
Q
Qualification (Qualifizierung)
R
Retrospective Validation (Retrospektive Validierung)
R
Revalidation (Revalidierung)
R
Risk Acceptance (Risikobereitschaft)
R
Risk Analyse (Risikoanalyse)
R
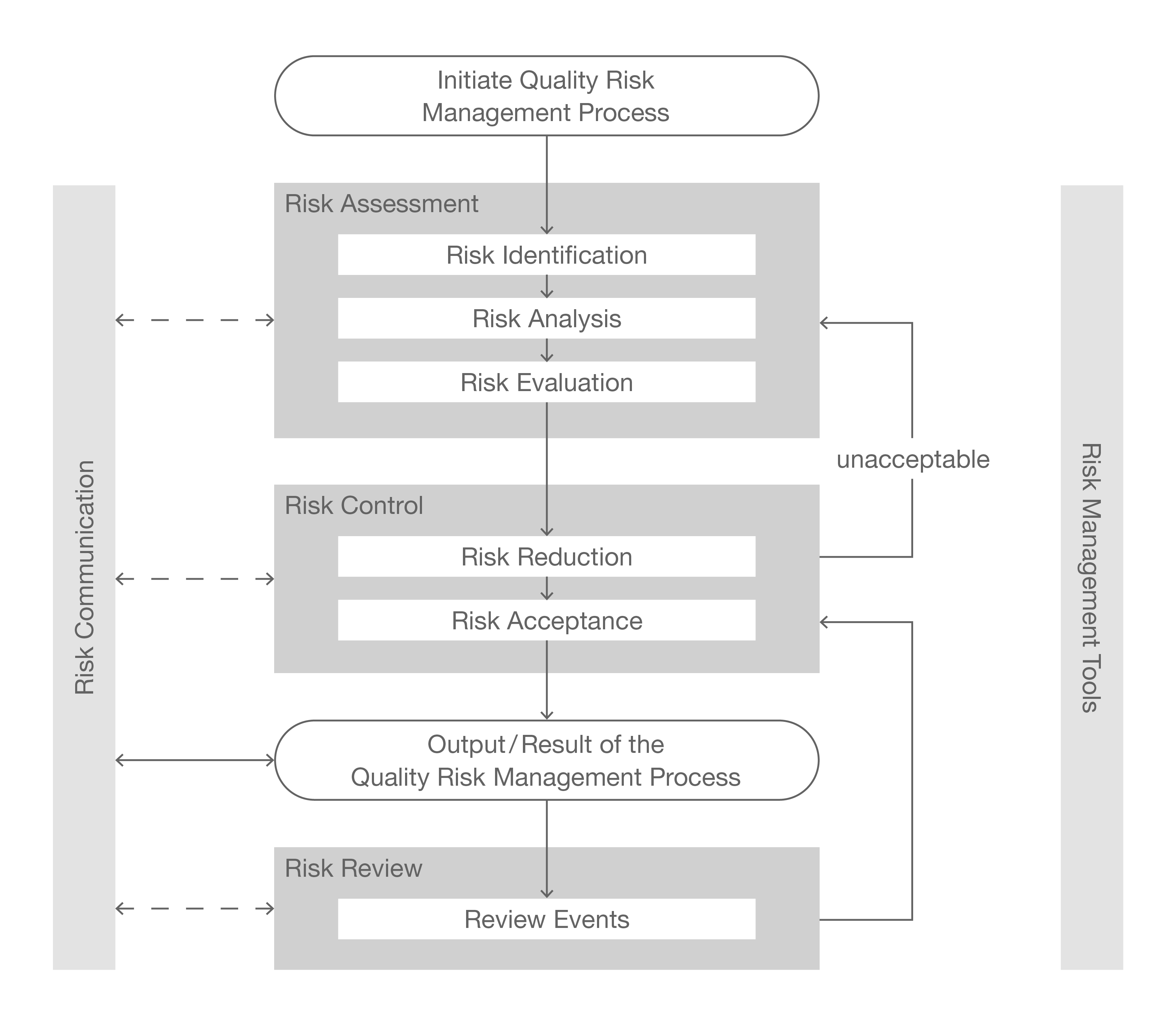
Risk Assessment (Risikobewertung)
R
Risk Communication (Risikokommunikation)
R
Risk Control (Risiko Kontrolle)
R
Risk Evaluation (Risikobewertung)
R
Risk Identifikation (Risikoermittlung)
R
Risk Management (Risikomanagement)
R
Risk Management Tools (Risikomanagementmethodik)
R
Risk Reduction (Risikoreduzierung)
R
Risk Review (Risikoüberprüfung)
S
SAL – Sterility Assurance Level (Sterilitätssicherheitsniveau)
S
Sanitization (Sanitisierung)
S
SAT – Site-Acceptance-Test (Abnahmetest vor-Ort)
S
SIP – Steam in Place (Sterilisierung vor Ort)
S
SMF – Site Master File (Standortdossier)
S
SOP – Standard Operation Procedure (Standard-Arbeitsanweisung)
S
Steam Quality (Dampfqualität)
S
SVPs – Small Volume Parenterals
T
Temperature (Heat) Penetration Study (Temperatur-Penetrationsstudie)
T
Temperature Mapping Study (Temperaturverteilungsstudie)
T
Traceability (Rückführbarkeit, Rückverfolgbarkeit)
U
URS – User-Requirements-Specifications (Benutzerspezifikationen)
U
USP® – United States Pharmacopeia (Arzneibuch USA)
V
Validation (Validierung)
V
Validation Matrix (Validierungsmatrix)
V
Validation Plan (Validierungsplan)
V
Validation Protocol (Validierungsprotokoll)
V
Validation Report (Validierungsbericht)
V
VMP – Validation Master Plan
W
WFI – Water-for-Injection (Wasser für Injektionszwecke)
W
WHO – World Health Organization (Weltgesundheitsorganisation)
W
WIP – Washing-in-Place (Reinigung vor Ort)
Z
Z-Value (Z-Wert)
Z